Aus dem Morbus-Bechterew-Journal Nr. 98 (September 2004)
Eine neue Hypothese zur Entstehung von Autoimmunerkrankungen, die mit dem HLA-B27 verknüpft sind
Patientenverständliche Fassung der mit dem DVMB-Forschungspreis
2004 gewürdigten wissenschaftlichen Arbeit
von Dr. rer. nat. Maria Diedrichs-Möhring und Privatdozentin
Dr. rer. nat. Gerhild Wildner, Arbeitsgruppe Immunbiologie, Augenklinik
der Ludwig-Maximilians-Universität München, Trägerinnen des DVMB-Forschungspreises 2004
Einleitung
Die Zellen des Immunsystems, die weißen Blutkörperchen,
haben normalerweise die Aufgabe, uns vor Krankheitserregern zu schützen.
Sie haben dafür verschiedene Strategien entwickelt: B-Lymphozyten
(kurz „B-Zellen“) bilden Antikörper, die Krankheitserreger erkennen,
binden und auf verschiedenen Wegen ausschalten können. T-Lymphozyten
(T-Zellen) können infizierte Zellen (bei einer Virusinfektion) oder
auch fremde Zellen (Transplantatabstoßung) direkt angreifen. Die
T-Zellen weisen eine Besonderheit auf: Sie erkennen „Fremdes“ nur im Zusammenhang
mit eigenen Eiweißmolekülen, den HLA-Molekülen (Humanes
Leukozyten-Antigen), die auf nahezu allen Zellen unseres Körpers vorhanden
sind. Diese Eiweißmoleküle werden in verschiedene Gruppen (HLA-A,
-B, -C) unterteilt, wobei es in jeder Gruppe eine große Anzahl verschiedener
Varianten gibt. Jeder Mensch besitzt von jeder Gruppe zwei verschiedene
Moleküle, von denen er eines von der Mutter und eines vom Vater geerbt
hat. Diese bilden ein individuelles, charakteristisches Muster auf Gewebezellen,
vergleichbar mit der individuellen Blutgruppe eines Menschen.
Diese gewebsständigen Eiweißmoleküle (HLA-Moleküle)
spielen bei der Immunantwort, also bei der Abwehr von Bakterien, Viren
und sonstigen Fremdstoffen eine wichtige Rolle, indem sie dem Immunsystem
die Fremdstoffe in Form von kleinen Eiweiß-Bruchstücken wie
auf einem Tablett „präsentieren“.
Unsere T-Zellen haben auf ihrer Oberfläche andere spezielle Moleküle
(„Rezeptoren“), die das fremde Eiweiß-Bruchstück auf
dem HLA-Molekül erkennen. Eiweißmoleküle („Proteine“)
bestehen aus Aminosäuren, von denen es 20 verschiedene gibt,
die für die unterschiedlichsten Eiweiße in immer wieder anderer
Reihenfolge kombiniert werden. Jedes Eiweiß hat also eine bestimmte
Aminosäure-Sequenz (Abfolge).
Die aus wenigen Aminosäuren bestehenden Protein-Bruchstücke
werden „Peptide“ genannt. Werden Peptide den T-Lymphozyten von einem
Gewebsantigen präsentiert, kann dies zur Aktivierung der Zellen des
Immunsystems und so zu einer Immunreaktion führen. Stammen die Peptide
von einem Krankheitserreger, ist diese Immunabwehrreaktion erwünscht.
Stammen die Peptide aber von einem körpereigenen Protein, sollten
sie toleriert werden, da sonst eine Autoimmunerkrankung ausgelöst
werden kann.
Bei einer Autoimmunerkrankung wie dem Morbus Bechterew kommt es zu
einigen Fehlregulationen im Immunsystem, so dass unser Immunsystem sich
nicht nur gegen fremdes Eiweiß, sondern auch gegen körpereigene
Strukturen richtet. Patienten mit Morbus Bechterew besitzen besonders häufig
ein bestimmtes Gewebsantigen, das HLA-B27. Dies legt die Vermutung nahe,
dass das HLA-B27-Molekül in irgendeiner Weise mitverantwortlich für
diese Fehlregulation sein könnte.
Tatsächlich werden nicht nur Fremdeiweiße in Bruchstücke
(Peptide) zerlegt. Auch körpereigene Eiweißmoleküle werden
ständig erneuert, die alten Moleküle abgebaut und in Peptide
zerlegt (Bechterew-Brief Nr. 82 S. 7–13). Normalerweise sieht unser
Immunsystem diese Fragmente nicht als fremd an, sondern „toleriert“ sie.
Unter bestimmten Umständen kann es aber vorkommen, dass ein körpereigenes
Peptid einem Fremd-Peptid (zum Beispiel aus einem Erreger) sehr ähnlich
ist und vom Immunsystem mit diesem verwechselt und angegriffen wird.
Auch HLA-Moleküle selbst werden, wie andere Eiweißmoleküle,
zum Abbau in Fragmente zerlegt. Das heißt, sie dienen zum einen der
Präsentation der Peptid-Antigene, können aber auch selbst Antigene
sein.
Wirkung von HLA-B27-Peptiden
Vor einiger Zeit konnten wir zeigen, dass T-Zellen von Morbus-Bechterew-Patienten
in der Lage sind, ein HLA-B27-Peptid (B27PA genannt) zu erkennen, während
weiße Blutzellen von gesunden Personen auf dieses Peptid nicht reagieren.
Aber warum kommt es ausgerechnet zu einer Arthritis (Gelenkentzündung)
und in bestimmten Fällen zu einer Iritis (Entzündung der
Augen-Regenbogenhaut)? Möglicherweise kommt es hier noch zu einer
Verwechslung des HLA-B27-Peptids mit einem Fragment des Strukturproteins
Cytokeratin (Ker333). Die Peptide B27PA und Ker333 ähneln sich in ihrer Aminosäure-Abfolge.
Cytokeratin kommt hauptsächlich in Gelenken, im Auge, in der Haut
und interessanterweise auch im Darm vor. Eine Immunreaktion auf Ker333
könnte also möglicherweise eine Arthritis, Iritis, Psoriasis
(Schuppenflechte) und/oder Colitis (entzündliche Darmerkrankung)
auslösen.
In Versuchen an unseren Ratten konnten wir zeigen, dass beide Peptide,
B27PA und Ker333, eine massive Arthritis in verschiedenen Pfotengelenken
sowie in der Schwanzwirbelsäule auslösen können.
Vergleicht man die Aminosäure-Sequenzen der beiden Ursprungsproteine
HLA-B27 und Cytokeratin in der unmittelbaren Nachbarschaft der Peptide
B27PA bzw. Ker333, so findet man weitere ähnliche bzw. gleiche
Aminosäuren in beiden Proteinen. Bei Verlängerung des Peptids
B27PA um 12 Aminosäuren (B27.60-84) erhielten wir ein Peptid, das
zu unserer Überraschung eine deutlich stärkere Arthritis
auslöste als das kürzere Peptid B27PA. Dies warf die Frage auf,
ob dieses Peptid in zwei pathogene (krankheitsverursachende) Peptide
zerlegt wird, man also die doppelte Antigenmenge zur Verfügung hätte,
oder ob die verstärkte Arthritis auf einem anderen Mechanismus
beruht. In der wissenschaftlichen Literatur ist dieses verlängerte
Peptid unter dem Namen „Allotrap“ bekannt. Von diesem Peptid wurde
beschrieben, dass es eine immunregulatorische Funktion hat. Im Tierversuch
blockiert es eine bestimmte Untergruppe der T-Zellen und hemmt so z.B.
die Abstoßung von Haut- oder Herztransplantaten. In diese Untergruppe
von T-Zellen gehören, neben den zytotoxischen (zelltötenden)
Zellen, die für Virusabwehr und Transplantatabstoßung verantwortlich
sind, auch sogenannte „Suppressorzellen“, die das Immunsystem dämpfen
und maßgeblich daran beteiligt sind, dass (auto)immune Reaktionen
„in Schach gehalten werden“. Werden diese Zellen in ihrer Funktion behindert,
verlaufen (auto)immune Reaktionen heftiger oder können überhaupt
erst ausgelöst werden.
Uveitis als Modellkrankheit
Wenn die Verstärkung der Immunreaktion durch „Allotrap“
auf einem Mechanismus beruht, der anscheinend unabhängig von der Arthritis
ist, so müssten wir diesen Verstärkungseffekt auch bei anderen
Autoimmunerkrankungen sehen. Hierzu haben wir als Modell die autoimmune
Uveitis gewählt, an der wir schon seit vielen Jahren arbeiten. Die autoimmune
Uveitis ist eine Entzündung des inneren Auges, die die Regenbogenhaut (Iris)
und /oder die Netzhaut betrifft (Bechterew-Brief Nr. 75 S. 26–28, Bechterew-Brief
Nr. 84 S. 3–8, Morbus-Bechterew-Journal Nr. 94 S. 6–9). Die Zerstörung
der empfindlichen Strukturen wie Lichtrezeptoren und Nervenzellen führt
zur Sehverschlechterung und in manchen Fällen sogar zur Erblindung.
Im Tiermodell von Ratte oder Maus kann die experimentelle autoimmune Uveitis
(EAU) durch Immunisierung (eine Art „Impfung“, durch die eine Immunantwort
angeregt wird) mit bestimmten Eiweißmolekülen aus dem Auge (retinale,
d.h. aus der Netzhaut stammende Autoantigene) oder ihren Fragmenten (Peptiden)
ausgelöst werden.
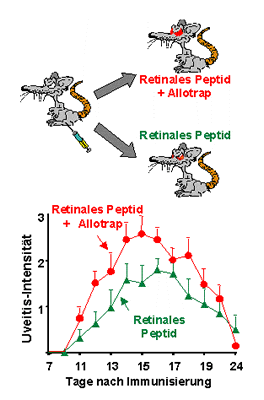
Wir haben nun untersucht, ob die gleichzeitige Immunisierung von Ratten
mit augentypischem Peptid (retinalem Peptid) und „Allotrap“
zu einer Verstärkung der Entzündung im Auge führt. Tatsächlich
war dies der Fall (Bild 1). Auch T-Zellen,
die wir aus immunisierten Tieren isoliert hatten, reagierten in der Zellkultur
stärker auf ihr spezifisches, zur Immunisierung benutztes Antigen-Peptid,
wenn zusätzlich „Allotrap“ in die Kulturschalen gegeben wurde.
In den Zell-Kulturen befand sich ein Gemisch aus Effektor-T-Zellen
(die eine autoimmune Reaktion auslösen können) sowie regulatorischen
(Suppressor-) Zellen, die die Effektor-Zellen hemmen. Wir interpretieren
diese Beobachtung als eine Unterdrückung der Suppressor-T-Zellen
(siehe oben), die normalerweise den Ausbruch von Autoimmunerkrankungen
verhindern. Funktioniert diese Regulation nicht mehr, kann eine autoaggressive
Immunreaktion ungehindert und somit heftiger ablaufen.
Bild 1: Werden Lewis-Ratten
(ein Ratten-Stamm, der sehr empfänglich für Autoimmunerkrankungen
ist) mit einem Gemisch aus Augenpeptid und dem HLA-B27-Peptid "Allotrap"
immunisiert, so wird eine deutlich stärkere Augenentzündung beobachtet
als nach alleiniger Immunisierung mit Augenpeptid.
Orale Toleranz
Im nächsten Schritt wollten wir untersuchen, ob wir mit “Allotrap”
auch solche Suppressorzellen unterdrücken können, die wir gezielt
für therapeutische Zwecke aktivieren. Solche Suppressorzellen können
z.B. durch „orale Toleranz“ erzeugt werden. Die orale Toleranz ist ein
wichtiger immunologischer Mechanismus, der verhindert, dass das Immunsystem
sich auch gegen Nahrungsmittelproteine wendet, was bei jeder Nahrungsaufnahme
zu einer Entzündung im Magen-Darm-Trakt führen würde (siehe
G. Wildner, Bechterew-Brief Nr. 84 S. 9–12). Ein Versagen der oralen
Toleranz kann Nahrungsmittel-Allergien oder sogar Autoimmunerkrankungen
zur Folge haben.
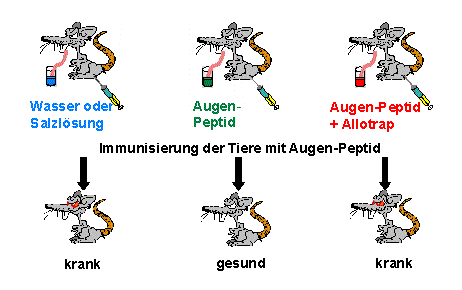
In unseren Versuchen an Ratten werden die Tiere mit dem augen-spezifischen
Autoantigen gefüttert und anschließend immunisiert, um die Uveitis
experimentell auszulösen (Bild 2).
Wir sehen eine deutliche Verminderung der Erkrankung in gefütterten
im Vergleich zu nicht mit Antigen gefütterten Tieren. Durch die Verabreichung
des Autoantigens über den Magen-Darm-Trakt werden spezifische Suppressorzellen
aktiviert, die die autoimmune Reaktion hemmen. Werden die Tiere dagegen
mit einer Mischung aus Autoantigen und „Allotrap“-Peptid gefüttert,
ist die Intensität der Uveitis zwar im Vergleich mit den nicht-gefütterten
Ratten etwas abgeschwächt, aber die Erkrankung war deutlich heftiger
als in den Gruppen mit alleiniger Fütterung von Autoantigen. Wir konnten
also beobachten, dass „Allotrap“ auch eine negative Auswirkung auf
die Aktivierung von Suppressorzellen im Magen-Darm-Trakt hat, d.h.
offensichtlich einen breiten Effekt auf verschiedene Suppressorzelltypen
ausüben kann.
Bild 2: Allotrap stört
die orale Toleranzinduktion: Das Füttern von Augen-Peptid
kann verhindern, dass eine anschließende Immunisierung mit diesem
Peptid eine Entzündung im Auge hervorruft (orale Toleranz). Wird aber
das Peptid „Allotrap“ zu dem Augen-Peptid hinzugefüttert, so erkranken
die Tiere trotzdem, da Allotrap die Suppressorzellen behindert, die die
orale Toleranz verursachen
Wir haben für unsere Experimente ein synthetisiertes „Allotrap“-Peptid
verwendet, vermuten aber, dass auch aus dem natürlichen HLA-B27-Molekül
unter bestimmten Vorraussetzungen das „Allotrap“-Peptid herausgeschnitten
werden kann. Dieses Peptid könnte zum einen direkt eine Arthritis
auslösen, da es den Bereich enthält, der mit Cytokeratin
verwechselt wird und autoaggressive T-Zellen aktiviert, andererseits enthält
es einen Abschnitt, der Suppressor-T-Zellen unterdrückt (Bild
3). Letztere halten vielleicht gerade die Balance zwischen notwendiger
Infektabwehr und unerwünschter überschießender Immunreaktion
aufrecht, und eine Störung dieses Gleichgewichts durch Beeinträchtigung
der Suppressorzellen könnte dann die ungehinderte Ausprägung
einer Autoimmunreaktion zur Folge haben. Dies wäre eine zusätzliche
Erklärung, warum besonders das HLA-B27-Molekül mit seiner „Allotrap“-Sequenz
so häufig bei Patienten mit bestimmten Autoimmunerkrankungen wie dem
Morbus Bechterew zu finden ist. Die Ergebnisse eröffnen neue Wege
für die Erforschung der Ursachen der Autoimmunreaktion beim Morbus
Bechterew. Eine genaue Kenntnis der Mechanismen der Erkrankung ist hilfreich
bei der Entwicklung neuer Therapien.
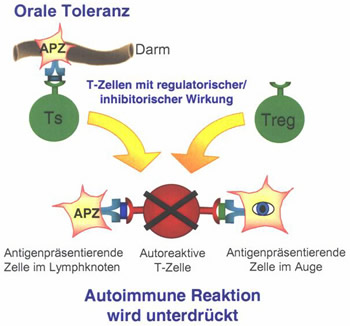
Ohne Allotrap:
Mit Allotrap:
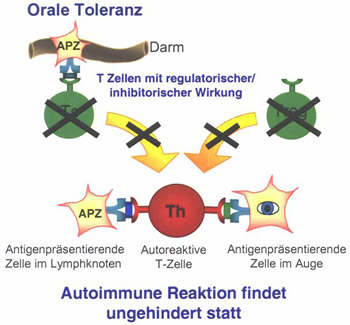
Bild 3: Vermutete Wirkung
von Allotrap auf die Funktion regulatorisch wirkender Zellen des Immunsystems.
Regulatorische
Zellen/ Suppressorzellen halten die Balance zwischen gewünschter Infektabwehr
und nicht erwünschter, überschießender (Auto-) Immunreaktion
aufrecht. Durch die Behinderung regulatorischer Zellen/ Suppressorzellen
durch Allotrap kann das Gleichgewicht in Richtung einer Autoimmunerkrankung
verschoben werden.